
近期,浙江省药品监督管理与产业发展研究会推出了《药品每日允许暴露量评估方法》的征求意见稿,这一举措标志着我国在药物每日允许暴露量(PDE)领域取得了重要进展,该指南也补充了国家药监局核查中心先前发布的《药品共线生产质量风险管理指南》及《清洁验证技术指南(征求意见稿)》中有关PDE的内容,为相关评估工作提供了更为全面的指导。此指南不仅为PDE评估建立了清晰的标准,还为药品生产企业在执行清洁验证时提供了不可或缺的参考。面对这一新规范,药企的验证管理员应如何高效、准确地开展PDE评估?接下来,本文将深入探讨这一问题。
01:制药人士都在关注的PDE相关概念与计算公式
在药品生产过程中,必须考虑多方面的安全因素。这包括保护生产线工人的安全以及确保药物的最终使用者——无论是患者还是目标物种——的安全。在共享设施中,交叉污染是一个潜在问题,因此需要根据GMP标准进行基于风险的评估,以确定允许的每日暴露量(PDE)。自2023年3月CFDI发布《药品共线生产质量风险管理指南》以来,传统的清洁残留限度1/1000和10ppm已不再适用,PDE重新成为制药企业关注的焦点。目前,无论是进行清洁验证还是共线生产,都需要利用PDE来计算清洁残留程度。那么,PDE究竟是什么?如何计算?
每日允许暴露量,英文Permitted Daily Exposure;简称PDE,是指在人的终生时长内,药物或产品每日可接受的最大摄入量。
PDE计算的一般公式:PDE(mg/day)=
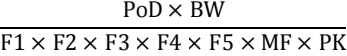

02:PDE评估的一般流程
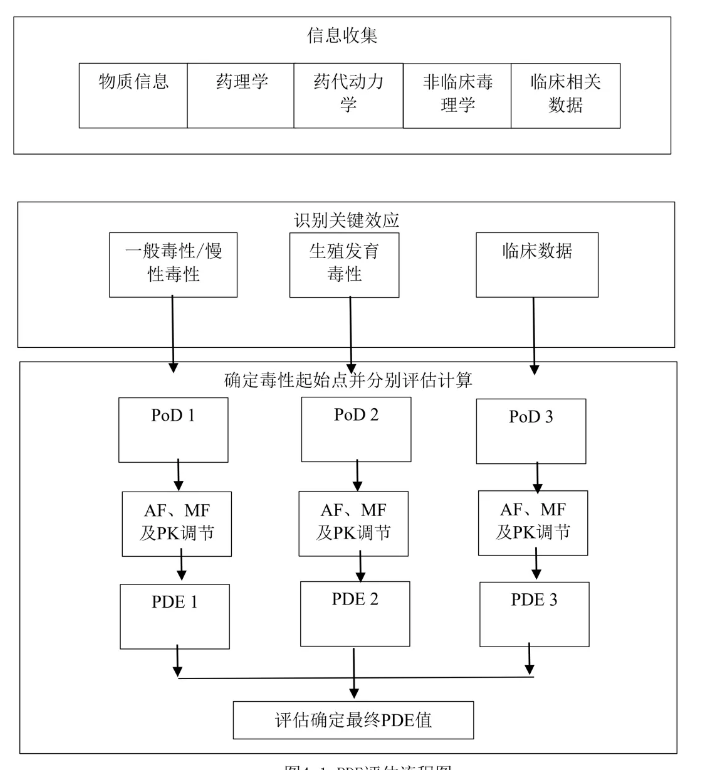
开展药品每日允许暴露量(PDE)评估时,首先需充分收集药品活性成分的非临床试验数据和人体临床使用数据。接着,通过数据评估识别关键效应,并选出相应的毒性起始点(PoD)。然后,根据相关指导原则和本标准的评估原则设置调节因子及其他因子,并依据公式计算得到PDE数值。这一流程确保了PDE评估的科学性和准确性,为药品的生产、研究和检测活动提供风险评估和管理的依据。药品每日允许暴露量(PDE)评估的一般流程包括以下步骤:
1.信息收集:
收集物质信息、药理学、药代动力学、非临床毒理学和临床相关数据。
2.识别关键效应:
识别所有危害效应中与目标人群相关的最敏感效应。
3.确定毒性起始点(PoD):
从已收集的非临床毒理学试验中的阈剂量、人体临床用量中选择相关数据用于PDE计算。
4.校正因子、MF因子及PK因子选择:
选择适当的校正因子(F1至F5)、修正因子(MF)和药代动力学因子(PK)进行调节。
5.计算及结果评估:
使用公式计算PDE值:PDE(mg/day)=PoD/(校正因子×MF因子×PK因子)。
基于不同的PoD计算得到多个PDE数值后,选择最低的PDE数据作为最终结果,或者基于科学性和人体相关性选择最能表征该物质非预期暴露风险的PDE数据作为评估结果。
6.评估确定最终PDE值:
综合考虑所有计算得到的PDE数值,确定最终的PDE值。
PDE评估的一般流程如下图:
03:《药品每日允许暴露量评估方法》标准信息
